12.03.2004
В последние десятилетия человечество столкнулось с очень серьезным вирусным заболеванием - синдромом
приобретенного иммунодефицита. Вирус, вызывающий это заболевание, получил название вирус иммунодефицита
человека (ВИЧ). В организме человека этот инфекционный агент поражает в первую очередь так называемые
Т-клетки (Т-лимфоциты) крови. Т-клетки - это "дирижеры иммунного оркестра", так как именно они
обеспечивают слаженность и взаимосвязанность всех компонентов специфического иммунного ответа. ВИЧ
вызывает значительное снижение количества Т-клеток в организме, что приводит к глубокой иммунологической
"катастрофе" у больных СПИД. Организм теряет способность сопротивляться инфекциям,
и "банальный" насморк может стать фатальным заболеванием.
Сложность борьбы с ВИЧ связана с тем, что этот вирус является одним из самых изменчивых
объектов в живой природе. В процессе терапии пациентов современными химиопрепаратами
быстро образуются устойчивые к ним варианты вируса. Кроме того, высокая изменчивость вируса позволяет
ему постоянно "ускользать" от действия иммунной системы хозяина. (Дополнительно о биологии ВИЧ можно
прочесть в статье "Вирус СПИДа - превращение в
зомби").
Вирус иммунодефицита человека относится к семейству ретровирусов. Помимо
иммунодефицитов, представители данного семейства способны вызывать целый ряд
тяжелых онкологических, гемопоэтических (т.е. связанных с гемопоэзом - системой
кроветворения) и неврологических заболеваний.
Вирусные частицы (вирионы) ВИЧ несут в своем составе геном, представленный молекулой РНК.
После инфицирования такой частицей сначала в цитоплазме клетки происходит синтез вирусного ДНК-генома с
использованием РНК в качестве матрицы. Все ретровирусы используют для репликации своего генома
механизм обратной транскрипции: вирусный фермент обратная транскриптаза вначале
синтезирует одну нить ДНК на матрице вирусной РНК, а затем уже на матрице синтезированной нити ДНК
достраивает вторую, комплементарную ей нить. Образуется двунитевая молекула ДНК, которая, проникнув
сквозь ядерную мембрану, интегрирует в хромосомную ДНК клетки и далее служит матрицей для синтеза
молекул вирусных РНК. Эти РНК выходят из клеточного ядра и в цитоплазме клетки упаковываются в вирусные
частицы, способные инфицировать новые клетки.
Геном вируса ВИЧ, помимо ферментов обратной транскрипции и структурных белков вириона, кодирует также
несколько так называемых аксессорных (вспомогательных) протеинов, функции которых остаются не до
конца выясненными. В прошедшем году внимание ученых, занимающихся ВИЧ, было приковано к одному из таких
белков - vif (virus infectivity factor - фактор вирусной инфекционности). О возросшем
интересе исследователей к этому белку указывает большое количество публикаций, посвященных его изучению
и вышедших в 2003г. в таких престижных журналах, как Cell, Science и Nature. На ежегодной международной
конференции по ретровирусам в Коулд Спринг Харборе в 2003г около четверти всех докладов имели отношение
к vif и его функциям.
До недавнего времени было известно лишь, что этот белок значительно повышает инфекционность вируса в
отношении некоторых типов клеток, таких, например, как Т-лимфоциты - основной мишени вируса в
инфицированном организме.
Ранее предполагалось, что vif необходим вирусу для успешной сборки вирусных частиц и их почкования из
клеток во внешнюю среду. Однако вирионы, продуцируемые зараженными клетками, в отсутствие vif физически
ничем не отличались от нормальных, но в то же время были малоинфекционны. Ряд данных, полученных
позднее, позволил предположить, что клетки, зараженные вариантом вируса, лишенным гена vif, способны
проявлять некую антивирусную активность, и в них размножение ВИЧ поэтому замедляется. В случае же
присутствия этого вирусного белка данная антивирусная активность подавляется. Это открытие побудило к
активным поискам клеточного антивирусного фактора.
В 2002г. эти поиски увенчались успехом: группой ученых из Медицинского университета Пенсильвании был
идентифицирован клеточный белок, ответственный за вирус-ингибирующую активность [1]. Этот белок получил
название APOBEC3G. Оказалось, что он принадлежит к семейству белков, участвующих в
химических модификациях РНК и ДНК.
Ген данного белка был выделен и клонирован. Перенос его в клетки кишечной палочки сильно повысил
уровень мутаций в бактериальной ДНК, причем эти мутации касались только замен основания G (гуанин) на А
(аденин). Дальнейшие исследования выявили механизм таких замен.
Было показано, что у бактерий введенный искусственно белок APOBEC3G отвечает за удаление аминной
группы (дезаминирование) из основания цитозин (С) ДНК, превращая его в урацил (U). Урацил
является нормальным основанием в составе РНК, однако он несвойственен для ДНК. В результате действия
APOBEC3G при репликации бактериальной ДНК появившийся в ней урацил вызывает ошибочное включение
комплементарного ему основания А (вместо G, который комплементарен исходному С) в строящуюся вторую
(дочернюю) нить ДНК. Таким образом у кишечной палочки происходит мутация - замена нуклеотидной
пары C-G на U-A.
Бактериальные клетки лишены ядерной оболочки, поэтому у них трансгенный APOBEC3G имел свободный
доступ к геномной ДНК. В клетках же высших (эукариотических) организмов APOBEC3G локализуется в
цитоплазме, поэтому он не представляет большой угрозы для ДНК самой клетки, защищенной ядерной
мембраной.
Но и вирусная ДНК также защищена от действия APOBEC3G: и на этапе заражения, и на стадии обратной
транскрипции, и при встраивании в хромосому вирусный геном "обернут" вирусными белками. Можно ли
"пробить" или "обойти" эту защиту? Оказывается, такой способ существует, и заключается не больше не
меньше - в "инфицировании" самого вируса на стадии его упаковки.
Исследования показали, что белок APOBEC3G способен специфически проникать в новообразовавшиеся
вирусные частицы ВИЧ [2]. После инфекции такими вирионами клетки, когда, как уже говорилось выше,
происходит синтез первой нити вирусной ДНК, APOBEC3G активирует в этой нити дезаминирование множества
оснований цитозина (С). Цитозин превращается в урацил, и далее в процессе синтеза второй нити ДНК на
матрице дезаминированной первой нити выполняется сценарий, описанный выше, т.е. происходит ошибочное
включение А вместо G (Рис. 1).
Дальнейшая судьба такой вирусной ДНК может быть различна. С одной стороны, ДНК ВИЧ, еще не
интегрированная в хромосомную, может распознаваться клеточной защитной ферментной системой. В этом
случае будет инициирована полная деградация (уничтожение) такой ДНК.
С другой стороны, если такая модифицированная ДНК интегрирует в клеточную хромосому, произошедшие в
ней массовые замены С на U приведут к активации клеточной системы репарации повреждений, которая в итоге
приведет к появлению так называемого гипермутантного вирусного генома. Количество мутаций (замен
пар C-G на A-T) в таком геноме настолько высоко, что он неспособен кодировать ни одного нормального
вирусного белка. Необходимо отметить, что такие гипермутантные вирусные геномы, в которых от 2 до 90%
всех оснований G заменены на А, ранее уже выделялись из крови инфицированных ВИЧ, но до настоящего
времени механизмы появления гипермутаций были непонятны.
Анализ ДНК vif-дефектных вариантов ВИЧ подтвердил наличие массовых гипермутаций, появляющихся после
всего одного цикла репликации вируса в клетке, что явилось окончательным доказательством механизма
антивирусной активности белка APOBEC3G [2, 3]. Была показана ингибирующая активность этого белка в
отношении не только ВИЧ, но и целого ряда других опасных ретровирусов. Таким образом, APOBEC3G является
естественным фактором, обеспечивающим специфическую защиту клетки от инфицирования ретровирусами. Этот
белок, по-видимому, не имеет другой физиологической функции в клетке. Его активность в отношении других
групп вирусов неизвестна.
Как же удается вирусу иммунодефицита защитить себя от клеточного "оружия массового мутирования"?
Оказывается, оружием ВИЧ как раз и служит белок vif, с которого мы начали рассказ. Как было показано,
уровень вирусной ДНК и время ее полужизни после инфекции клетки вариантом вируса иммунодефицита с
дефектным вирусным белком vif значительно ниже по сравнению с нормальным вирусом. Каким же образом vif
препятствует действию APOBEC3G?
В настоящее время известно, что vif существенно уменьшает количество проникающих в вирионы молекул
APOBEC3G [3]. Отчасти это происходит за счет vif-опосредованной деградации самого белка APOBEC3G и
уменьшения его общего содержания в клетке. Vif способен связываться с APOBEC3G в цитоплазме
инфицированных клеток и индуцировать последующее взаимодействие APOBEC3G с протеасомой -
комплексом ферментов, ответственных за деградацию клеточных белков. Показано также, что vif каким-то
образом способствует исключению APOBEC3G из собирающихся вирусных частиц [2] (см. рис. 2). Не
исключается и возможность прямого ингибирования белком vif ферментативной активности APOBEC3G в
вирионах. В вопросе о механизмах действия vif еще много неясностей, требующих дальнейших исследований.
Могут ли описанные выше последние открытия послужить основой для создания новой антивирусной терапии,
направленной на борьбу с ВИЧ и вызываемым этим вирусом заболеванием? Безусловно, и здесь возможны два
различных подхода.
Во-первых, экспериментально доказано, что сверхвысокая экспрессия белка APOBEC3G в клетках способна
преодолеть действие vif. Таким образом, индукция высокого уровня данного белка в клетке может быть одним
из путей терапии СПИД. Впрочем, для использования данного подхода необходимо вначале ответить на вопрос
- насколько безопасным для клетки будет высокое содержание белка, способного так модифицировать ДНК.
Другим, по всей видимости более перспективным направлением, может быть целенаправленный поиск
препаратов, способных взаимодействовать с белком vif и ингибировать его действие.
Удастся ли использовать полученные данные на практике и достичь перелома в борьбе с ВИЧ - мы вскоре
узнаем.
1. Sheehy A.M. et al. Isolation of a human gene that inhibits HIV-1 infection and is suppressed by
the viral Vif protein. Nature (2002) vol. 418 (6898). P.646-650.
2. Lecossier D. et al. Hypermutation of HIV-1 DNA in the absence of the Vif protein. Science (2003),
vol. 300 (5622). P. 1112.
3. Zhang H. et al. The cytidine deaminase CEM15 induces hypermutation in newly synthesized HIV-1 DNA.
Nature (2003), vol. 424 (6944), P. 94-98.
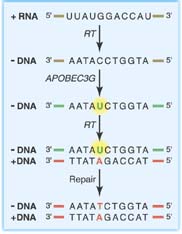
После проникновения вирусной частицы, содержащей клеточный белок APOBEC3G, в новую клетку, вирусный
фермент обратная транскриптаза (RT) обеспечивает синтез первой нити ДНК (-DNA) на матрице вирусной РНК
(+RNA). Затем APOBEC3G индуцирует дезаминирование оснований цитозина (С), превращая их в урацил (U,
выделен желтым). Во время синтеза второй цепи ДНК (+DNA) обратная транскриптаза включает основание А
напротив U (тогда как в норме должен быть G напротив C). Интеграция такого вирусного генома в хромосому
и воздействие на него клеточной системы репарации ДНК приводят к накоплению мутаций (обозначены буквами
красного цвета) и формированию гипермутантного вирусного генома.
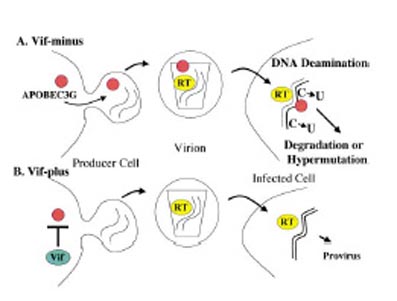
А. В процессе сборки вирусных частиц дефектного по белку vif (Vif-minus) варианта вируса клеточный
белок APOBEC3G проникает в вирионы. При последующей инфекции новых клеток APOBEC3G вызывает накопление
большого числа оснований урацила (U) в вирусной ДНК, что приводит к ее деградации или образованию
гипермутантных вирусных геномов.
В. В случае присутствия вирусного белка vif (Vif-plus) клеточный белок APOBEC3G исключается из
собирающихся вирионов, что ведет к образованию нормальных вирусных геномов.